Arrhythmien / Herzinsuffizienz
Vorhofflimmern
Bei Follow-up Untersuchungen von über 120'000 Patienten mit einem aktuen Koronarsyndrom (ACS) aus mehreren randomisierten Studien hat sich gezeigt, dass das Auftreten von Vorhofflimmern mit einer Inzidenz von rund 7.5% häufig ist und mit einer schlechteren Prognose assoziiert ist. Bei ACS mit und ohne ST-Hebungen erhöht ein Vorhofflimmern das Risiko für zukünftige Myokardinfarkte sowie die Mortalität [1]. Ein Vorhofflimmern bei Patienten mit akutem inferiorem Infarkt erhöht indessen das Risiko, in Zukunft an einem Hirnschlag zu erkranken [2]. Bei solchen Patienten sollte demnach eine orale Antikoagulation erwogen werden.
Tveit et al haben einen Marker identifiziert, der das Risiko für das Auftreten eines erneuten Vorhofflimmerns nach Kardioversion besser abschätzen lässt: den Plasminogen activator inhibitor-1 (PAI-1). Spiegel über 12.2
U/ml waren bei Patienten mit persistierendem Vorhofflimmern mit einem signifikant höheren Risiko für ein Rezidiv nach Kardioversion assoziiert als Werte unter 12.2 U/ml.
Resynchronisationstherapie (CRT)
Vorhofflimmern spielt auch eine prognostische Rolle bei CRT. Mit CRT behandelte Patienten mit einem Vorhofflimmern überleben weniger lang als solche mit einem Sinusrhythmus, obwohl alle klinisch gleich gut auf die CRT ansprechen [3]. Das Hauptkriterium für oder gegen eine CRT bleibt zur Zeit die QRS-Dauer [4].
Prävention des plötzlichen Herztodes bei chronischer Herzinsuffizienz
Risikopopulation und präventive Strategien
P. Ponikowski, Wroclaw, Polen
Welche Patienten tragen welches Risiko?
80-90% aller Herzinsuffizienzpatienten sterben an einer kardiovaskulären Ursache; 25-50% der Todesfälle sind auf einen plötzlichen Herztod zurückzuführen [5]. Dabei ist die Ursache des Todes abhängig von der Stärke der Herzinsuffizienz. Patienten mit ausgeprägter Symptomatik (NYHA IV) sterben eher an einem Pumpversagen des Herzens, solche mit leichterer Herzinsuffizienz eher am plötzlichen Herztod. Risikofaktoren für einen plötzlichen Herztod sind
- Hohes koronares Risiko
- Episoden früherer ventrikulärer Arrhythmien
- Ejektionsfraktion (EF) < 35%
- Reanimation nach lebensbedrohlicher Arrhythmie
- Status nach Myokardinfarkt
- Nachgewiesene ventrikuläre Arrhythmien
Ein Patient mit Status nach Myokardinfarkt, welcher eine EF < 35% hat und bei dem bereits ventrikuläre Arrhythmien nachgewiesen wurden, hat ein Risiko von 30%, an einem plötzlichen Herztod zu sterben [6]. Ein plötzlicher Herztod ist nicht immer das Ergebnis einer tödlichen Tachyarrhythmie. Eine Untersuchung an 29 unerwarteten Todesfällen bei Patienten mit fortgeschrittener Ventrikeldysfunktion hat gezeigt, dass bei 48% eine Bradyarrhythmie oder eine elektromechanische Dissoziation vorgelegen hatte [7].
Präventive Strategien
Bezüglich Sekundärprävention lassen die 2005 publizierten Guidelines zur Behandlung der Herzinsuffizienz keinen Zweifel daran, dass die Implantation eines ICD bei Patienten mit Status nach überlebtem plötzlichem Herzkreislaufstillstand oder solchen mit anhaltender ventrikulärer Tachykardie empfohlen werden sollte [8].
Komplizierter ist das Vorgehen bei der Primärprävention eines plötzlichen Herztodes. Bereits vor 5 Jahren konnten Moss und Kollegen in einer randomisierten Studie bei über 1’200 Patienten mit Status nach akutem Myokardinfarkt und einer EF <30% zeigen, dass die Implantation eines ICD mit einer Reduktion der Gesamtmortalität um 31% assoziiert war [9]. Die Resultate der SCD-HeFT Studie wurden 2005 publiziert und wiesen bei NYHA II und III Herzinsuffizienz-Patienten mit einer EF < 35% nach einem Follow up von 45 Monaten eine Mortalitätsreduktion um 23% nach, wenn ein ICD eingebracht wurde [10].
Amiodaron reduziert die Mortalität bei Patienten mit Herzinsuffizienz nicht [10]. Einige Betablocker hingegen sind bei Herzinsuffizienz bewiesenermassen mit einer signifikanten Reduktion des Risikos für einen plötzlichen Herztod assoziiert: Bisoprolol reduzierte in der CIBIS II Studie, welche aufgrund der eindrücklichen Resultate vorzeitig beendet werden musste, die Gesamtmortalität um 34% und das Risiko, an einem plötzlichen Herztod zu sterben, um 44% [11]. Etwas weniger, aber immer noch statistisch signifikant, waren die Risikoreduktionen unter Metoprolol und Carvedilol [12,13].
Ausser den Betablockern haben auch gewisse Angiotensinrezeptor- Blocker und Aldosteron-Antagonisten einen günstigen Einfluss auf die Mortalität gezeigt [14,15]. Viel versprechend sind die Ergebnisse einer posthoc Analyse der CIBIS II Studie zur Evaluation der Kombination eines Statins mit dem Betablocker Bisoprolol bei Patienten mit Herzinsuffizienz, gemäss der bei Patienten unter der aktiven Studienmedikation bisher kein einziger plötzlicher Herztodesfall aufgetreten ist [16].
Herzinsuffizienz: Betablocker oder ACE-Hemmer zuerst?
R. Willenheimer, Lund, Schweden
Betablocker und ACE-Hemmer sind beides Wirkstoffklassen, welche bei einer Herzinsuffizienz einen günstigen Einfluss auf die Prognose haben. Aufgrund der hohen Letalität durch einen plötzlichen Herztod – gerade in der frühen Phase der Erkrankung – sowie der Tatsache, dass das sympathische Nervensystem früher aktiviert wird als das Renin-Angiotensin-Aldosteron-System, könnte der initialen Verabreichung eines Betablockers jedoch noch mehr Gewicht zukommen als der ACE-Hemmer Gabe, wenn nicht beide Medikamente in voller Dosierung sofort eingesetzt werden können. Die CIBIS III Studie hat die beiden Strategien – zuerst Betablocker, dann ACE-Hemmer oder umgekehrt – miteinander verglichen[17].
In die randomisierte, kontrollierte CIBIS III Studie wurden 1’010 mindestens 65-jährige Patienten mit einer NYHA II oder III Herzinsuffizienz und einer linksventrikulären EF von maximal 35% eingeschlossen. Während 6 Monaten erhielten die Patienten entweder täglich Bisoprolol (initial 1.25 mg, Zieldosis 10 mg) oder zweimal täglich Enalapril (initial 2 x 2.5 mg, Zieldosis 2 x 10 mg) als Monotherapie. Nach einem halben Jahr wurden die beiden Medikamente kombiniert eingenommen. Primäre Endpunkte der Studie waren Tod, Hospitalisation und die Kombination von Tod oder Hospitalisation.
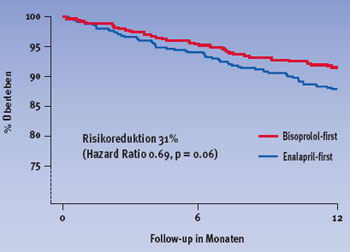
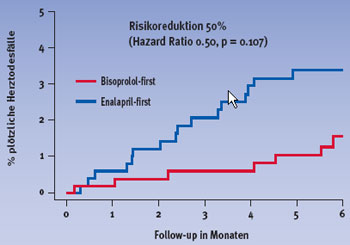
Ein primäres Endpunktereignis – Tod oder Hospitalisation – trat in der Bisoprolol-first Gruppe bei 178 und in der Enalapril-first Gruppe bei 186 Patienten auf (Hazard Ratio 0.94, relative Risikoreduktion 6%). Die Gesamtmortalität nach einem Jahr sowie am Ende der Studie war unter Bisoprolol-first geringer als unter Enalapril-first. Dies galt vor allem für die Todesfälle aufgrund eines plötzlichen Herztodes, wie Abbildungen 1 und 2 zu entnehmen ist.
 |
|
Abbildung 1: Gesamtüberleben nach einem Jahr | |
| |
 |
|
Abbildung 2: Plötzliche Herztodesfälle nach einem Jahr | |
| |
Bezüglich Verträglichkeit und Sicherheit zeigten sich kaum Unterschiede zwischen den beiden Studiengruppen. Verschlechterungen der Herzinsuffizienz traten unter der Betablockertherapie nicht häufiger auf als unter Enalapril. Unterschiede bei der Nierenfunktion waren statistisch ebenfalls nicht signifikant. Patienten mit normaler oder leichter renaler Dysfunktion schienen von der Bisoprolol-first Strategie bezüglich Tod oder Hospitalisation mehr zu profitieren als solche mit mittelschwerer oder schwerer Nierenfunktionsstörung. Nebenwirkungen insgesamt waren in beiden Therapiegruppen gleich häufig.
Von wesentlicher Bedeutung war der Nachweis, dass der günstige Effekt der Medikation, insbesondere der Betablockade, hoch signifikant ausgeprägter war, wenn das Medikament ausdosiert wurde, respektive eine Dosis von mehr als 50% der Zieldosierung erreicht wurde.
Praktisch wichtige Aspekte – Interview mit Prof. G. Noll, Zürich
Herr Prof. Noll; seit der Publikation der CIBIS III Studienergebnisse wissen wir, dass der Patient mit leichter bis mittelschwerer Herzinsuffizienz von der initialen Verabreichung eines Betablockers mindestens so viel profitiert wie vom ACE-Hemmer. Nach welchen Kriterien entscheiden Sie sich für welche initiale Medikation?
Grundsätzlich sagen die Guidelines nach wie vor, dass bei Patienten mit einer eingeschränkten linksventrikulären Funktion initial mit einem ACE-Hemmer begonnen werden sollte. Ich ziehe jedoch aufgrund der CIBIS III-Studienresultate bei kardial kompensierten Patienten mit Rhythmusstörungen sowie erhöhter Herzfrequenz den Betablocker als first-line-Medikation vor.
Eine Subgruppenanalyse lässt vermuten, dass vor allem Patienten mit erhaltener und lediglich leichter Nierenfunktionsstörung vom Betablocker profitieren. Berücksichtigen Sie die Nierenfunktion bei der Therapiewahl mit? Und beeinflusst das Vorliegen einer KHK Ihren Entscheid?
Wir wissen seit längerer Zeit, dass ACE-Hemmer bei Patienten mit Nephropathie einen günstigen Einfluss auf den weiteren Verlauf der Nierenfunktion haben. Patienten mit Herzinsuffizienz weisen nicht selten eine meist prärenal bedingte Niereninsuffizienz auf, die sich unter ACE-Hemmern noch weiter verschlechtern kann. Bei diesen Patienten erwäge ich eine Behandlung mit einem Betablocker anstelle des ACE-Hemmers. Auch bei Patientin mit deutlich eingeschränkter Nierenfunktion ziehe ich den Betablocker als erstes Medikament in Betracht. Ein weiteres Argument für den Betablocker stellt das Vorliegen einer Myokardischämie bzw. einer Angina pectoris dar.
Der Respekt vor Nebenwirkungen der Betablocker sitzt bei Ärzten und Patienten tief. Nachgewiesenermassen ist die Wirksamkeit aber von der Ausdosierung abhängig. Wie gehen Sie beim Therapiebeginn mit Betablockern konkret vor – und – nach welchen Kriterien entscheiden Sie sich für welchen Betablocker?
Ich setze grundsätzlich nur Betablocker ein, für die gezeigt wurde, dass sie in grossen klinischen Studien bei Patienten mit Herzinsuffizienz bzw. eingeschränkter linksventrikulärer Funktion von Nutzen sind (Bisoprolol, Carvedilol, Metoprolol, Nebivolol). Bei Patienten mit Herzinsuffizienz sind Betablocker initial in geringen Dosen einzusetzen, da sie vorübergehend die hämodynamische Situation verschlechtern können. Bei Zunahme des Körpergewichtes bzw. Flüssigkeitsretention versuche ich die Therapie unverändert weiterzuführen und gleichzeitig die Dosis der Diuretika zu erhöhen. Die Dosissteigung der Betablockerbehandlung sollte in kleinen Schritten über mehrere Wochen erfolgen.
Prof. Noll, herzlichen Dank für die Beantwortung der Fragen
Referenzen
1. Lopes R et al, Abstract 1594
2. Jim MH et al, Abstact 4267
3. Leclercq C et al, Abstract 1862
4. Ghio S et al, Abstract 3222
5. Solomon SD et al. Effect of candesartan on cause-specific mortality in heart failure patients: the Candesartan in Heart failure Assessment of Reduction in Mortality and morbidity (CHARM) program. Circulation 2004;110:2180-2183 6. Myerburg RJ et al. Interpretation of outcomes of antiarrhythmic clinical trials: design features and population impact. Circulation 1998;97:1514- 1521
7. Stevenson WG et al. Sudden death prevention in patients with advanced ventricular dysfunction. Circulation 1993;88:2953-2961
8. Swedberg K et al. Guidelines for the diagnosis and treatment of chronic heart failure: executive summary (update 2005): The Task Force for the Diagnosis and Treatment of Chronic Heart Failure of the European Society of Cardiology. Eur Heart J 2005;26:1115-1140
9. Moss AJ et al. Prophylactic implantation of a defibrillator in patients with myocardial infarction and reduced ejection fraction. N Engl J Med 2002;346:877-883
10. Bardy GH et al. Amiodarone or an implantable cardioverter-defibrillator for congestive heart failure. N Engl J Med 2005;352:225-237
11. No authors listed. The Cardiac Insufficiency Bisoprolol Study II (CIBIS-II): a randomised trial. Lancet 1999;353:9-13
12. Hjalmarson A et al. Effects of controlled-release metoprolol on total mortality, hospitalizations, and well-being in patients with heart failure: the Metoprolol CR/XL Randomized Intervention Trial in congestive heart failure (MERIT-HF). MERIT-HF Study Group. JAMA 2000;283:1295-1302
13. Dargie HJ. Effect of carvedilol on outcome after myocardial infarction in patients with left-ventricular dysfunction: the CAPRICORN randomised trial. Lancet 2001;357:1385-1390
14. Solomon SD et al. Effect of candesartan on cause-specific mortality in heart failure patients: the Candesartan in Heart failure Assessment of Reduction in Mortality and morbidity (CHARM) program. Circulation 2004;110:2180-2183
15. Pitt B et al. The EPHESUS trial: eplerenone in patients with heart failure due to systolic dysfunction complicating acute myocardial infarction. Eplerenone Post-AMI Heart Failure Efficacy and Survival Study. Cardiovasc Drugs Ther 2001;15:79-87
16. Krum H et al. Impact of statin therapy on clinical outcomes in chronic heart failure patients according to beta-blocker use: results of CIBIS II. Cardiology 2007;108:28-34
17. Willenheimer R et al. Effect on survival and hospitalization of initiating treatment for chronic heart failure with bisoprolol followed by enalapril, as compared with the opposite sequence: results of the randomized Cardiac Insufficiency Bisoprolol Study (CIBIS) III. Circulation 2005;112:2426-2435
| |
| Mediscope |
| |
| 13.11.2007 - dde |
| |
 |
|